北京大学雷晓光课题组与合作者-北京生命科学研究所董梦秋课题组近期在《Nature Communications》杂志上发表论文,开发出新型精氨酸选择性化学交联剂ArGO和精氨酸/赖氨酸双选择性化学交联剂KArGO,并且证明该类新型化学交联剂可以极大推动化学交联质谱技术发展,帮助阐明复杂蛋白质结构和发现新的蛋白质相互作用。文章题目为:“Improving mass spectrometry analysis of protein structures with arginine-selective chemical cross-linkers”。 化学交联结合质谱技术 (chemical cross-linking coupled with mass spectrometry, CXMS) 是近年来迅猛发展的一种检测蛋白质结构和蛋白质相互作用的方法。随着质谱仪器以及交联数据搜索软件的发展,CXMS技术已经获得了长足的进步,但在该技术中能够应用的交联剂类型却并不丰富。目前商业可购买的交联剂主要是针对蛋白质N端和赖氨酸残基,还有少量针对半胱氨酸残基。精氨酸在蛋白质中含量丰富 (>5%),而且经常出现在蛋白质相互作用界面中。但目前还没有成熟的针对精氨酸残基选择性的交联剂被开发出来。
化学交联质谱
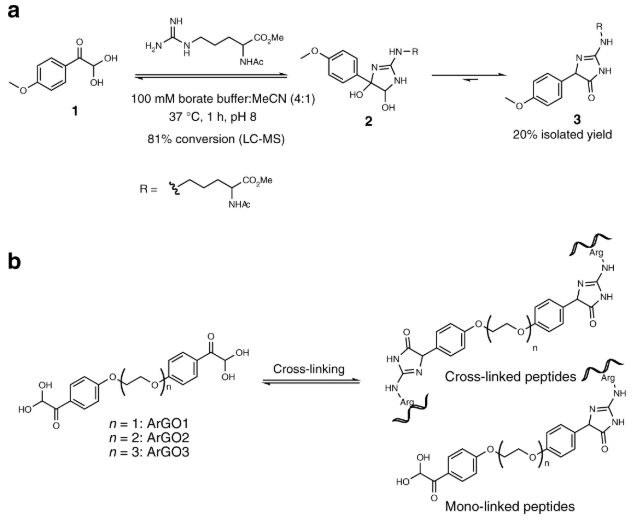
为了进一步丰富交联剂的种类,雷晓光课题组与董梦秋课题组合作开发了靶向精氨酸的交联剂。该系列交联剂在不同长度的聚乙二醇单元两端连接芳基取代甲酰甲醛结构(aromatic glyoxal),分别命名为ArGO1-3交联剂。此外根据甲酰甲醛结构的相对位置、苯基取代情况、交联剂臂长情况以及化学连接方式的情况,还开发出meta-ArGO1-2、ortho-ArGO1、MeO-ArGO1-2、HP-ARGO1以及amide-ArGO1-2等一系列ArGO交联剂。 ArGO交联剂可以共价连接蛋白质表面两个精氨酸残基。该反应具有良好的化学选择性,交联位点具有广泛的互补性。 除此之外,雷晓光课题组还将ArGO交联剂进行结构拓展,将交联剂一端换为靶向赖氨酸残基的邻苯二甲醛结构,并将其命名为KArGO交联剂。KArGO交联剂可以共价连接蛋白质表面精氨酸残基和赖氨酸残基,进一步增加了交联位点可能性,提高了交联肽段的结构覆盖度,并在多样品测试中表现出稳定可靠的交联效果。 董梦秋课题组将ArGO和KArGO交联剂运用到CNGP和UtpA等蛋白质复合物的结构鉴定中。增加了ArGO和KArGO交联剂的特异性交联位点信息后,模拟的蛋白质结构与晶体结构吻合度更好。此结果表明ArGO和KArGO交联剂弥补了已有赖氨酸交联剂的不足,提供了丰富的互补结构信息(图3)。该工作所开发出的新型交联剂即将由百灵威科技有限公司进行商业化推广,从而帮助进一步推进CXMS技术在分析复杂蛋白质结构和发现新型蛋白质相关作用研究中的广泛应用。 雷晓光课题组英国籍博士后Alexander X. Jones博士以及博士生唐毓良,董梦秋课题组博士生曹勇作为该文章的共同第一作者。文章的通讯作者是雷晓光博士和董梦秋博士。该工作还得到了中科院计算所贺思敏课题组,北京生命科学研究所邵峰课题组、黄牛课题组,以及中科院生物物理所叶克穷课题组的帮助。上述研究得到了科技部-国家重点研发计划-蛋白质机器与生命调控专项、973计划、国家自然科学基金委(杰青、重点、面上、创新群体项目)、北大-清华生命科学联合中心基金、中科院和北京市政府的资助,在北京大学和北京生命科学研究所完成。
雷晓光,北京大学化学与分子工程学院教授, 药学院-天然与仿生药物国家重点实验室兼职教授,主要从事天然产物全合成、化学生物学与创新药物研究。2001年本科毕业于北京大学化学学院;2006年获得美国波士顿大学有机合成化学博士学位;2006-2008年在美国哥伦比亚大学从事生物有机化学博士后研究;2008-2013年任北京生命科学研究所研究员、高级研究员,2014年全职加入北京大学化学学院。
在蛋白质组学分析方法中,质谱获得的是多肽序列结构的信息;那么用质谱是否可研究大分子蛋白的结构信息?近几年来,董梦秋实验室在中国做出了多项先驱性工作,主要集中在化学交联质谱领域。在用单颗粒冷冻电镜技术研究结构生物学屡创佳绩的当下,很多研究者都把样品一分为二,一份做冷冻电镜,一份做交联质谱。 在当今的结构生物学研究中,冷冻电镜是主力。从单颗粒冷冻电镜图像中把形态相近的颗粒挑出来进行对齐、平均、三维重构,可以得到高分辨度的电子密度图,然后搭建蛋白质复合体的结构模型。可是,蛋白质柔性区域的结构无论用电镜还是晶体学技术都很难看清楚,甚至完全不可见,这样建模的时候会遇到断头路,往下接到哪儿是个问题。交联质谱数据告诉我们,两个被交联的氨基酸残基空间距离不会超过某个上限。有了足够多的交联距离约束信息后,我们就可以把断头路接起来,并推断出柔性区的位置和分布方式。目前很多结构生物学实验室在制备冷冻电镜样品时会分出一部分做交联质谱,后期匹配两种数据以获得更完整的结构。而Native MS(非变性质谱)可以提供蛋白质复合体组成亚基的化学计量比,帮助搭建合理的结构模型。Foot Printing(足迹法)用化学试剂标记暴露在环境中的氨基酸残基,酶解后可用质谱检测被修饰的肽段,从而了解哪些氨基酸分布在蛋白质的外表面以及蛋白质形成复合体后被包埋的区域。交联质谱数据中的mono-link肽段(交联剂一端与肽段共价连接,另一端水解而形成的修饰单肽)也可以提供同类信息。氢氘交换不受化学修饰试剂的选择性限制,可以做得更精细。
| 